ACTUALIZACIÓN al 28/8/2023
Takeda, de acuerdo con la Administración de Medicamentos y Alimentos de EE. UU. (FDA), ha decidido reemplazar voluntariamente los dispositivos de reconstitución BAXJECT® II producidos por Baxter entre octubre de 2021 y enero de 2022 empaquetados conjuntamente para su uso junto con RECOMBINATE™ [Factor antihemofílico (recombinante) ] y RIXUBIS® [Coagulación [Factor IX (Recombinante)].
Takeda ha recibido informes de partículas blancas identificadas cerca del puerto luer del dispositivo BAXJECT II (ver imágenes a continuación). Todos los incidentes informados hasta la fecha se observaron antes de la administración, ya sea cuando se retiró la tapa del puerto luer como parte del proceso de preparación o en la jeringa después de reconstituir el medicamento. Es importante tener en cuenta que no hay ningún problema de calidad con el medicamento RECOMBINATE y/o RIXUBIS y, por lo tanto, los productos son seguros de usar. No se han identificado partículas en el producto activo antes de la reconstitución. No se informaron eventos adversos atribuibles a la presencia de partículas en el dispositivo BAXJECT II en nuestras bases de datos de Takeda Global Safety que condujeron al reemplazo voluntario del dispositivo de reconstitución BAXJECT II. Los perfiles de seguridad y eficacia de RECOMBINATE y RIXUBIS siguen siendo consistentes con la información de prescripción del producto.
Takeda proporcionará dispositivos de reconstitución BAXJECT II de reemplazo a los proveedores farmacéuticos que hayan recibido lotes afectados para su distribución a los pacientes y la reconstitución del producto según las Instrucciones de uso. Consulte la siguiente información sobre los pasos para comunicarse con su proveedor de farmacia para solicitar dispositivos BAXJECT II de reemplazo.
Reemplazo de dispositivos impactados
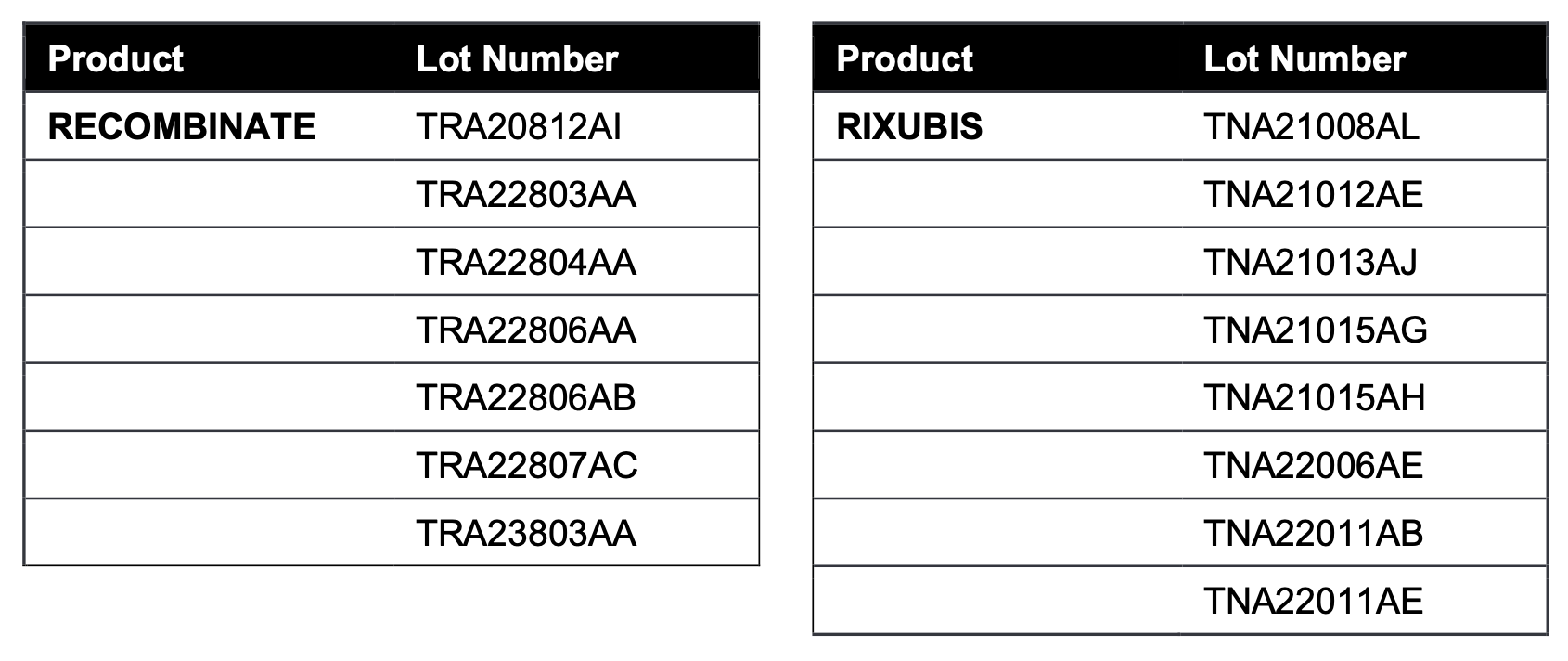
Los lotes afectados de DISPOSITIVOS BAXJECT II empaquetados conjuntamente con RECOMBINATE y RIXUBIS se enumeran a continuación:
Examine cualquier producto RECOMBINATE y/o RIXUBIS que tenga en su poder para identificar los lotes afectados. Puede localizar el número de lote en el exterior del embalaje del producto (consulte la imagen a continuación).
• Si tiene lotes de productos RECOMBINATE y/o RIXUBIS impactados en su poder, comuníquese con su proveedor de farmacia para solicitar dispositivos BAXJECT II de reemplazo. El proveedor de la farmacia le enviará los dispositivos de reemplazo directamente.
• Al recibir el dispositivo de reemplazo BAXJECT II, debe seguir cuidadosamente las Instrucciones de uso para la preparación y administración del producto RECOMBINATE y/o RIXUBIS.
• En las Instrucciones de uso, cuando se le solicite abrir el paquete del dispositivo BAXJECT II contenido en el kit, el paciente debe desechar el dispositivo BAXJECT II original y utilizar el nuevo dispositivo BAXJECT II de repuesto proporcionado.
• Si tiene más preguntas, comuníquese directamente con su proveedor de farmacia o con su proveedor de atención médica.
Notificación de eventos adversos
Se recomienda a los proveedores de atención médica y a los pacientes que informen reacciones adversas y/o problemas de calidad relacionados con el dispositivo de reconstitución BAXJECT II, RECOMBINATE y/o RIXUBIS a Takeda al 1-877-TAKEDA-7 (1-877-825-3327). Le recomendamos que informe a la FDA sobre los efectos secundarios negativos de los medicamentos recetados. Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088.
Tenga en cuenta que la seguridad del paciente y la continuidad del suministro son nuestras principales prioridades y estamos trabajando urgentemente para proporcionar dispositivos BAXJECT II de reemplazo a los clientes.
ACTUALIZACIÓN al 24/08/2023
El Consejo Asesor Médico y Científico de la Fundación Nacional de Trastornos de la Sangrado emitió el siguiente aviso médico sobre un problema con ciertos dispositivos de reconstitución BAXJECT® II:
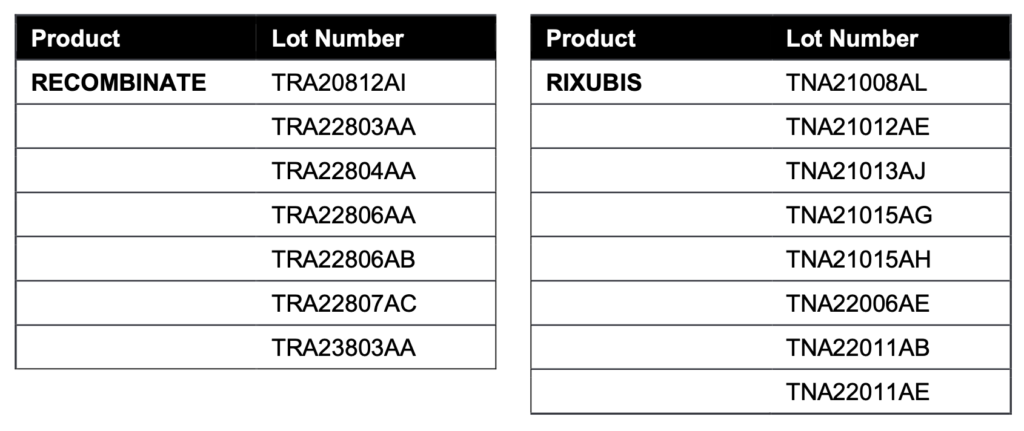
Los números de lote involucrados en este aviso:
Takeda nos ha llamado la atención sobre un problema con algunos dispositivos de reconstitución BAXJECT® II producidos entre octubre de 2021 y enero de 2022 para su uso junto con RECOMBINATE [factor antihemofílico (recombinante)] y RIXUBIS® [factor IX de coagulación (recombinante)] en los EE. UU. informado el 16 de agosto de 2023 aquí.
Takeda notificó a la Administración de Alimentos y Medicamentos de EE. UU. (FDA) sobre informes de partículas de plástico originadas cerca del puerto luer del dispositivo BAXJECT II. Todas las quejas reportadas hasta la fecha se observaron antes de la administración, ya sea cuando se quitó la tapa del puerto luer como parte del proceso de preparación o en la jeringa después de reconstituir el medicamento. Hasta la fecha, no se han informado eventos adversos atribuibles al dispositivo BAXJECT II. Según se informa, estas partículas son demasiado grandes para transferirse desde el medicamento contaminado a través de la aguja, el tubo y al paciente.
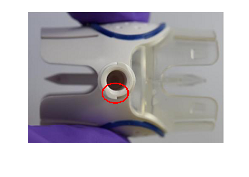
Dispositivo de reconstitución BAXJECT II

Puerto Luer en el dispositivo
Takeda informa que ADVATE, ADYNOVATE y otros productos de Takeda no se ven afectados ya que el dispositivo BAXJECT II solo está empaquetado para uso con RIXUBIS y RECOMBINATE en los Estados Unidos. Takeda está trabajando con la FDA para obtener orientación adecuada para los próximos pasos, y los números de lote específicos de los factores afectados no están disponibles actualmente. Mientras tanto, MASAC recomienda a los pacientes que utilizan RECOMBINATE y RIXUBIS revisar e inspeccionar visualmente cuidadosamente su suministro de medicamentos antes de la inyección. tanto en el frasco como en la jeringa. La solución reconstituida debe tener un aspecto entre incoloro y amarillo pálido y estar libre de partículas extrañas. En caso de que se identifiquen partículas en el producto reconstituido, no administre el producto. MASAC aconseja a los pacientes que utilizan RECOMBINATE y RIXUBIS® que puedan haber sido afectados que se comuniquen con su centro de tratamiento si corresponde. Alternativamente, los pacientes podrían considerar mezclar su producto usando un método alternativo, como el uso de una aguja con filtro colocada en el extremo de la jeringa durante la mezcla del producto. Para obtener instrucciones sobre cómo hacer esto y cómo obtener suministros, comuníquese con su centro de tratamiento o farmacia. Los pacientes también pueden comunicarse con su centro de tratamiento o farmacia para volver a solicitar un nuevo producto de factor que no esté empaquetado con el dispositivo BAXJECT II fabricado en el período de tiempo antes mencionado. MASAC continuará trabajando para difundir información adicional a medida que esté disponible.
Se recomienda a los proveedores de atención médica y a los pacientes que informen reacciones adversas y/o problemas de calidad relacionados con el dispositivo de reconstitución BAXJECT II, RECOMBINATE y/o RIXUBIS a Takeda al 1-877-TAKEDA-7 (1-877-825-3327). Le recomendamos que informe a la FDA sobre los efectos secundarios negativos de los medicamentos recetados. Visite www.fda.gov/medwatch o llame al 1-800-FDA-1088.