
Lo siguiente es un comunicado de prensa de Bayer con respecto a un retiro voluntario. ¡LOS PACIENTES NO DEBEN UTILIZAR ESTE PRODUCTO!
Bayer retira voluntariamente dos lotes de Kogenate® FS factor antihemofílico (recombinante) viales de 2000 UI en los Estados Unidos al nivel del paciente. Ciertos viales de estos dos lotes que fueron etiquetados como Kogenate FS en realidad contienen el tratamiento para la hemofilia A FVIII, Jivi® factor antihemofílico (recombinante) PEGilado-aucl 3000 UI. Estados Unidos es el único país donde se distribuyeron los productos afectados. Estamos trabajando estrechamente con la Administración de Alimentos y Medicamentos de EE. UU. para gestionar el retiro y minimizar las interrupciones en el suministro y las molestias a los pacientes. Los lotes afectados, distribuidos desde 5 de febrero de 2019 a 15 de julio de 2019 de los centros de distribución de Bayer en Berkeley, California, y Shawnee, Kansas., están enlistados debajo:
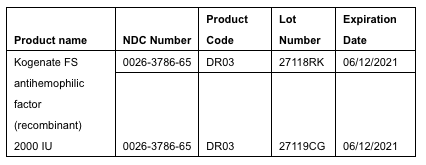

Si bien se recuperaron la mayoría de los viales mal etiquetados en los lotes afectados, aproximadamente 990 de estos viales se liberaron en los EE. UU. El lote asociado de Jivi expiró a partir de agosto 2018. Sin embargo, todas las especificaciones de estabilidad de este lote de Jivi caducado se seguían cumpliendo, a partir de abril 2019. Hemos retirado voluntariamente ambos lotes en aras de la seguridad del paciente y para garantizar que cualquier producto potencialmente afectado se retire de los estantes de las farmacias y que los pacientes y sus proveedores de atención médica sean alertados. Es importante destacar que los viales de Kogenate FS que no están asociados con los números de lote afectados (27118RK y 27119CG) no se ven afectados y pueden seguir utilizándose sin interrupción. No hay muchos Jivi o Kovaltry® Producto de factor antihemofílico (recombinante) afectado por este retiro del mercado.
La seguridad del paciente es la máxima prioridad de Bayer. Estamos monitoreando cuidadosamente cualquier queja o informe de eventos adversos que pueda estar relacionado con este retiro del mercado. La compañía emite esta notificación después de descubrir el problema a principios de esta semana. Tras una evaluación interna inmediata, Bayer se puso en contacto con la FDA para informar a la agencia de la situación.
Kogenate FS y Jivi son medicamentos que se usan para reemplazar el factor de coagulación (factor VIII o factor antihemofílico) que falta en personas con hemofilia A. Kogenate FS está aprobado para tratar o controlar el sangrado en adultos y niños con hemofilia A. Jivi está aprobado para tratar y controlar el sangrado en adultos y adolescentes (de 12 años de edad y mayores) con hemofilia A previamente tratados.
Los pacientes que tengan viales de los números de lote afectados deben dejar de usar el producto inmediatamente y ponerse en contacto con su médico. Además, los pacientes deberán contactar con su farmacia para devolver el producto afectado. Bayer notifica por escrito a sus distribuidores para que revisen sus existencias de inmediato y suspendan la distribución y el uso de cualquier producto afectado. Para los distribuidores que tengan preguntas sobre el proceso de retirada, comuníquese con el Coordinador de retirada de Bayer, Inmar, al 855-707-7518.
Bayer se compromete a brindar a nuestros pacientes una terapia segura y eficaz. Alentamos a los proveedores de atención médica y a los pacientes que tengan preguntas a que llamen a nuestra línea directa de comunicaciones médicas si tienen preguntas: 1-888-84-BAYER (1-888-842-2937).
Entendemos que esta noticia puede resultar preocupante para los pacientes con hemofilia A que dependen de estos medicamentos. Bayer se compromete a proporcionar la información más actualizada y precisa a quienes puedan verse afectados por este problema. Bayer se toma muy en serio su asociación de 30 años con la comunidad de hemofilia y seguimos profundamente dedicados a satisfacer las necesidades de los pacientes que viven con esta enfermedad de por vida.
Se anima a los pacientes y proveedores de atención médica a informar a la FDA sobre los efectos secundarios o las quejas sobre la calidad de los productos visitando www.fda.gov/medwatch o llamando al 1-800-FDA-1088. Para los productos de Bayer, puede informarlos directamente a Bayer en http://adversereactions.bayer.com.
Lea el comunicado de prensa de Bayer Aquí.A



